[FONT="]Bu ders notumuzda Fizik dersinin Isı-Sıcaklık konusu altında; Isı Nedir? Sıcaklık Nedir? Isı ile Sıcaklığın Birbirinden Farkı, Sıcaklığın Ölçülmesi (Termometreler) Sıcaklık Değerlerini Birbirine Dönüştürmek, Sıcaklık Değişimi, Öz Isı, Isı Sığası, Isı Alış Verişi, Erime Sıcaklığı, Erime Isısı, Erime ve Donmaya Etki Eden Faktörler (Basıncın Erime ve Donmaya Etkisi, Safsızlığın Erime ve Donmaya Etkisi) Kaynama, Buharlaşma, Süblimleşme, Suyun Hal Değişim Grafiği vb. başlıklar hakkında detaylı bilgileri bulabilirsiniz.[/FONT]
[h=1]ISI-SICAKLIK[/h][FONT="]Bazen buzun eridiğini ya da suyu donduğunu ya da tellerin uzayıp kısalması gibi olayların nedeni ısı-sıcaklıdır. Isı ile sıcaklık birbirinden farklı noktaları vardır.[/FONT]
[h=3]Sıcaklık[/h][FONT="]Bir maddenin belli bir ölçüye göre, soğukluğunu veya ılıklığını gösteren nicelik, sıcaklık olarak bilinir.[/FONT]
[FONT="]Bir maddedeki her molekülün kinetik enerjisi farklı farklıdır. Bütün moleküllerin kinetik enerjilerinin toplamı, toplam molekül sayısına bölünürse, ortalama kinetik enerjisi bulunur. Bu ortalama kinetik enerji sıcaklığın bir ölçüsüdür. Bu değerin yüksek olduğu madde daha sıcak, düşük olduğu maddenin sıcaklığı ise daha düşük demektir.[/FONT]
[FONT="]Bir maddenin ortalama kinetik enerjisi ile orantılı olan büyüklüğe sıcaklık denir. Bir maddenin sıcaklığı değişiyorsa, çevresine ısı veriyor ya da çevresinden ısı alıyordur.[/FONT]
[h=1]Isı[/h][FONT="]Sıcaklıkları farklı olan maddeler bir araya konulduğunda aralarında enerji alış verişi olur. Alınan ya da verilen enerji ısı enerjisi denir.[/FONT]
[h=3]Isı ile Sıcaklığın Birbirinden Farkı[/h]
[h=3]Sıcaklığın Ölçülmesi (Termometreler)[/h][FONT="]Sıcaklık ölçmek için kullanılan araçlara termometre denir. Maddelerin boyutlarında meydana gelen değişim, sıcaklıktaki değişim olarak kabul edilebilir. Termometreler bu esasa göre düzenlenmişlerdir.[/FONT]
[FONT="]Termometrelerde 76 cm-Hg basıncında sabit iki sıcaklık değeri seçilir. Birisi suyun donma sıcaklığı diğeri ise suyun kaynama sıcaklığıdır.[/FONT]
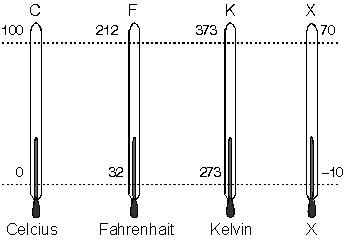
[h=3]Sıcaklık Değerlerini Birbirine Dönüştürmek[/h][FONT="]Sıcaklık T ile sembolize edilir.[/FONT]
[FONT="]Celcius (Santigrad °C) termometrelerinde, suyun donma sıcaklığı 0 °C , kaynama sıcaklığı 100 °C alınarak, 100 eşit bölme yapılmıştır.[/FONT]
[FONT="]Kelvin suyun donma sıcaklığını 273 °K, kaynama sıcaklığını ise 373 °K alarak 100 eşit bölme yapmıştır.[/FONT]
[FONT="]Herhangi bir X termometresinde ise, suyun donma sıcaklığı – 10 °X, kaynama sıcaklığı ise 70 °X alınarak, 80 eşit bölme yapılmıştır.[/FONT]
[FONT="]
 [/FONT]
[/FONT]
[FONT="]Termometrelerdeki sıcaklık değerlerini birbirine dönüştürmek için,[/FONT]
[FONT="]
 [/FONT]
[/FONT]
[FONT="]eşitlikleri kullanılabilir.[/FONT]
[FONT="]Buradan çıkan sonuca göre, Celcius termometresindeki sıcaklık değeri 1 bölme yükselirse, Fahrenhait’te; 1,8 bölme, Kelvin’de 1 bölme; X termometresinde ise; 0,8 bölme yükselir.[/FONT]
[FONT="]Örneğin hava sıcaklığı 10 °C iken, Fahrenhait termometresi[/FONT]
[FONT="]F = 18 + 32 = 50 °F değerini gösterir.[/FONT]
[FONT="]Termometrenin Duyarlılığı[/FONT]
[FONT="]Küçük sıcaklık değişimlerinden etkilenen termometrelerin duyarlılığı daha fazladır. Bunun için termometrenin haznesinde daha fazla sıvı ve sıcaklıkla daha çok genleşen sıvı olmalıdır. Cıvanın tercih edilmesi bundan dolayıdır. Ayrıca kılcal boru dar olmalı ki genleşen sıvının hareketi rahat gözlenebilsin.[/FONT]
[FONT="]Yerçekim kuvvetinin sıfır olduğu bir yerde termometre çalışır. Çünkü genleşme yerçekimine bağlı değildir.[/FONT]
[FONT="]Isı Enerjisi[/FONT]
[FONT="]Maddenin sıcaklığını artırmak için verilmesi gereken enerji çeşidine ısı enerjisi denir. Q ile gösterilir. Isı bir enerji çeşidi olduğundan enerji birimleri ısı birimleri olarak alınabilir. Uluslararası birim (SI) sistemine göre enerji birimi Joule (Jul)dür.[/FONT]
[FONT="]1 cal = 4,18 Joule dür.[/FONT]
[h=3]Sıcaklık Değişimi[/h][FONT="]Elimizle bir maddeye dokunduğumuzda sıcaklık hissediyorsak madde elimize ısı veriyordur. Dokunduğumuzda soğukluk hissediyorsak elimiz maddeye ısı veriyordur.[/FONT]
[FONT="]Buna göre, sıcaklıkları farklı olan iki madde karıştırıldığında ya da birbirine değecek şekilde yan yana konulduğunda aralarında ısı alış verişi olur. Sıcak olan madde ısı verip sıcaklığı azalırken, sıcaklığı düşük olan madde ısı alarak sıcaklığı artar ve sonuçta ısıl denge sağlanır.[/FONT]
[h=3]Öz ısı[/h][FONT="]Herhangi bir maddenin 1 gr sıcaklığını 1°C artıran ısı miktardır. Her maddenin öz ısısı farklıdır.Dolayısıyla ayırt edeci bir özelliktir. Öz ısı “c” ile gösterilir. Ayırt edeci özellik madde miktarına bağlı değildir.[/FONT]
[FONT="]Bir cismin m gramının sıcaklığını DT kadar değiştirmek için verilmesi ya da alınması gereken ısı miktarı[/FONT]
[FONT="]Q=m.c.Dt[/FONT]
[FONT="]bağıntısı ile bulunur.[/FONT]
[FONT="]Bu bağıntıya göre, eşit kütleli maddelere eşit miktar ısı verildiğinde, öz ısısı küçük olan maddenin sıcaklık değişimi, öz ısısı büyük olanınkine göre daha fazla olur.[/FONT]
[h=3]Isı Sığası[/h][FONT="]M kütleli bir maddenin sıcaklığını 1°C artırmak iin gerekli olan ısı miktarıdır. Bir maddenin kütlesi ile öz ısısının çarpımına (m.c) ısı sığası denir. Isı sığası madde miktarına bağlıdır. Dolayısıyla ayırt edici bir özellik değildir.[/FONT]
[h=3]Isı Alış Verişi[/h][FONT="]Sıcakları farklı cisimler bir araya getirildiğinde sıcak cisim ısı vererek soğurken, soğuk cisim ısı alarak ısınır. Cisimler arasındaki ısı alışverişi iki isminde son sıcaklıkları eşitleninceye kadar devam eder. Isı akışı sıcak cisimden soğuk cisme doğru olur. Her zaman alınan ısı verilen ısıya eşittir.[/FONT]
[FONT="]Qalınan = Qverilen[/FONT]
[FONT="]m1 . c1 . DT1 = m2 . c2 . DT2[/FONT]
[FONT="]İki madde arasında hal değişimi yok ise, yukarıdaki eşitlik geçerlidir. Isıl denge sağlandığında iki maddenin son sıcaklığı kesinlikle eşit olur.[/FONT]
[FONT="]Sıcaklıkları T1 °C ve T2 °C olan aynı cins sıvıdan eşit kütleli karışım yapılırsa, karışımın son sıcaklığı[/FONT]
[FONT="]
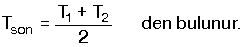 [/FONT]
[/FONT]
[FONT="]karışımın son sıcaklığı, karışan sıvıların sıcaklıkları arasında bir değerdir. T2 > T1 ise, T2 > Tson > T1 olur.[/FONT]
[h=3]ERİME ve DONMA[/h][FONT="]Maddelerin içinde bulunduğu sıcaklığa göre, katı, sıvı ve gaz halinde bulundukları biliniyor. Maddeler ısı alarak ya da ısı vererek bir halden diğer bir hale geçiş yapabilirler. Maddelerin bir halden başka bir hale geçmesine hal değiştirme denir.[/FONT]
[FONT="]Maddelerin katı halden sıvı hale geçmesine erime, sıvı halden katı hale geçmesine de donma denir.[/FONT]
[FONT="]Hal değişim sırasında maddelerin hacminde de değişme olur.[/FONT]
[h=3]Erime Sıcaklığı[/h][FONT="]Sabit atmosfer basıncı altında bütün katı maddelerin katı halden sıvı hale geçtiği sabit bir sıcaklık değeri vardır. Bu sıcaklık değerine erime sıcaklığı ya da erime sıcaklık noktası denir.[/FONT]
[FONT="]Sabit atmosfer basıncı altında her maddenin erime sıcaklığı farklı olduğu için maddeler için ayırt edici bir özelliktir. Örneğin deniz düzeyinde buzun erime sıcaklığı 0 °C dir.[/FONT]
[h=3]Erime Isısı[/h][FONT="]Erime sıcaklığındaki bir katının 1 gramının yine aynı sıcaklıkta sıvı hale gelmesi için verilmesi gerekli ısıya erime ısısı denir. Erime ısısı da ayırt edici bir özelliktir. Kütlesi m olan, erime sıcaklığındaki bir katıyı eritmek için verilmesi gereken ısı miktarı,[/FONT]
[FONT="]bağıntısı ile bulunur.[/FONT]
[FONT="]Örneğin, buzun erime ısısı Le = 80 cal/g dır.[/FONT]
[FONT="]Sıvı bir maddenin ısı vererek katı haline geçmesine donma denir. Sabit atmosfer basıncı altında bütün sıvı maddelerin katı hale geçtiği sabit bir sıcaklık değeri vardır. Bu değere donma sıcaklığı ya da donma sıcaklık noktası denir.[/FONT]
[FONT="]Erime ile donma birbirinin tersidir. Bundan dolayı bir maddenin erime sıcaklığı, donma sıcaklığına eşittir. Erime ısısı da donma ısısına eşittir. Örneğin deniz düzeyinde 0 °C deki su donarken dışarı 80 cal/g lık ısı verir.[/FONT]
[h=3]Erime ve Donmaya Etki Eden Faktörler[/h][FONT="]Erime ve donma sıcaklığı normal şartlarda sabittir. Eğer basınç ve maddenin saflığı değiştirilirse, maddelerin erime ve donma sıcaklığıda değişir.[/FONT]
[h=5]1. Basıncın Erime ve Donmaya Etkisi[/h][FONT="]Basınç, birim yüzeye etkiyen dik kuvvet olduğundan, maddenin moleküllerini bir arada tutarak dağılmasını önleme yönünde etki eder.[/FONT]
[FONT="]Erirken hacmi artan maddeler için, basıncın artması erimeyi zorlaştırdığı için erime noktası yükselir. Basıncın azalması ise, erime noktasını düşürür.[/FONT]
Deniz düzeyinde, normal basınçta 0 °C de eriyen buz, basınç artırılmasıyla sıfırın altındaki bir sıcaklıkta da eriyebilir.[/FONT]
[FONT="]Yüksek dağların zirvesindeki karların yaz mevsiminde de erimemesinin nedenlerinden birisi de açık hava basıncının yükseklere çıkıldıkça azalması ve karın erime noktasının yükselmesidir.[/FONT]
[h=5]2. Safsızlığın Erime ve Donmaya Etkisi[/h][FONT="]Saf bir maddenin içine başka bir madde karıştırılırsa, maddenin saflığı bozulur. Saf olmayan bu karışımın, saf maddeye göre erime ve donma sıcaklığı değişir.[/FONT]
[FONT="]Arabaların soğutucu suyunun içine antifriz denen maddenin karıştırılması suyun donma noktasını[/FONT]
[FONT="]– 20 °C, – 25 °C gibi sıcaklıklara indirmektedir.[/FONT]
[FONT="]Kışın hava sıcaklığının 0 °C nin altında olduğu durumlarda, yollardaki buzu eritmek için, tuz dökülür. Tuz, buzun erime noktasını düşürür ve (–) değerli sıcaklıklarda da buz eriyebilir.[/FONT]
[FONT="]KAYNAMA, BUHARLAŞMA ve SÜBLİMLEŞME[/FONT]
[h=3]Buharlaşma[/h][FONT="]Sıvı bir maddenin ısı olarak gaz haline geçmesi olayına buharlaşma denir. Buharlaşma olayı sıvı yüzeyinde olur. Isı alan sıvı moleküllerinden bazıları sıvı yüzeyinde,moleküller arası çekim kuvvetini ve sıvının yüzey gerilimini yenerek gaz fazına geçer.[/FONT]
[FONT="]Buharlaşmaya basınç ve diğer fiziksel şartların etkisi çoktur.[/FONT]
[h=3]Kaynama Sıcaklığı[/h][FONT="]Sabit atmosfer basıncı altında bütün sıvı maddelerin, sıvı halden gaz hale geçtiği sabit bir sıcaklık değeri vardır. Bu sıcaklık değerine kaynama noktası denir. Kaynama sıcaklığı maddeler için ayırt edici bir özelliktir.[/FONT]
[h=3]Buharlaşma Isısı[/h][FONT="]Kaynama noktasına gelmiş 1 gram sıvı maddenin tamamının aynı sıcaklıkta gaz haline gelmesi için verilmesi gereken ısıya buharlaşma ısısı denir. Buharlaşma ısısı Lb ile gösterilir. Kaynama sıcaklığındaki m gramlık maddeyi gaz haline getirmek için verilmesi gereken ısı miktarı[/FONT]
[FONT="]Q=m.Lb[/FONT]
[FONT="]bağıntısı ile bulunur. Suyun buharlaşma ısısı[/FONT]
[FONT="]Lb = 540 cal/g dır. Buharlaşma ısısı maddeler için ayırt edici bir özelliktir.[/FONT]
[FONT="]Gaz halindeki bir maddenin ısı vererek sıvı hale geçmesine yoğunlaşma denir. Erime ve donmada olduğu gibi, yoğunlaşma da, kaynamanın tersidir. Dolayısıyla bir maddenin kaynama sıcaklığı ile yoğunlaşma sıcaklığı eşittir. Buharlaşma ısısı ile yoğunlaşma ısısı da eşittir.[/FONT]
[h=3]Süblimleşme[/h][FONT="]Bazı katı maddeler ısıtılınca sıvı hâle geçmeden doğrudan gaz hâle geçerler. Bu olaya süblimleşme denir. Naftalin, ernet ve bazı koku yayan maddelerin zamanla azaldığı görülür. Fakat hiç sıvılaştığı görülmez. Bu tür maddelerde süblimleşme olur.[/FONT]
[FONT="]Kaynama ve Yoğunlaşmaya Etki Eden Faktörler[/FONT]
[FONT="]Yine erime ve donmada olduğu gibi, kaynama ve yoğunlaşmaya etki eden faktörler vardır. Basınç ve maddenin saflığının değiştirilmesi, kaynama sıcaklığını etkiler.[/FONT]
[FONT="]· Kaynama olayının gerçekleşmesi için, buhar basıncının atmosfer basıncına eşit olması gerekir. Atmosfer basıncı artarsa, ağzı açık kaptaki sıvının kaynaması zorlaşır. Atmosfer basıncının azalması ise kaynamayı kolaylaştırır. Dolayısıyla sıvı daha düşük sıcaklıkta kaynar.[/FONT]
[FONT="]Düdüklü tencerede basıncın artmasıyla sıvının kaynama sıcaklığı artırılır, dolayısıyla yemekler daha çabuk pişer.[/FONT]
[FONT="]· Saf sıvı içine karıştırılan farklı maddeler sıvının saflığını bozar. Saflığı bozulan sıvının kaynama noktası değişir. Örneğin suyun içine tuz karıştırılırsa, kaynama noktası yükselir.[/FONT]
[h=3]Suyun Hal Değişim Grafiği[/h][FONT="]Bir parça buz ısıtıldığında önce sıcaklığı artar. Erime sıcaklığına geldiğinde hal değiştirmeye başlar ve buzun tamamı eriyinceye kadar sıcaklığı değişmez. Isı enerjisi verilmeye devam edildiğinde, suyun sıcaklığı artar ve 100 °C de kaynamaya başlar. Sıvının tamamı bitinceye kadar sıcaklık değişmez. Bu açıklamaya göre buzun sıcaklık-aldığı ısı enerjisi grafiği şekildeki gibi olur.[/FONT]
[FONT="]
 [/FONT]
[/FONT]
[FONT="]Buzun erime ısısı Le = 80 cal/g, buharlaşma ısısı[/FONT]
[FONT="]Lb = 540 cal/g dır. Dolayısıyla 0 °C deki 1 gram buzu eritmek için 80 calorilik ısı gerekirken, 100 °C deki 1 gram suyu gaz haline geçirmek için 540 calori gerekir. Bundan dolayı DQ1 < DQ2 dir.[/FONT]
[FONT="]Madde ısı hızı sabit olan ocakla ısıtılıyorsa, ısı ekseni yerine zaman ekseni alınabilir.[/FONT]
[h=1]ISI-SICAKLIK[/h][FONT="]Bazen buzun eridiğini ya da suyu donduğunu ya da tellerin uzayıp kısalması gibi olayların nedeni ısı-sıcaklıdır. Isı ile sıcaklık birbirinden farklı noktaları vardır.[/FONT]
[h=3]Sıcaklık[/h][FONT="]Bir maddenin belli bir ölçüye göre, soğukluğunu veya ılıklığını gösteren nicelik, sıcaklık olarak bilinir.[/FONT]
[FONT="]Bir maddedeki her molekülün kinetik enerjisi farklı farklıdır. Bütün moleküllerin kinetik enerjilerinin toplamı, toplam molekül sayısına bölünürse, ortalama kinetik enerjisi bulunur. Bu ortalama kinetik enerji sıcaklığın bir ölçüsüdür. Bu değerin yüksek olduğu madde daha sıcak, düşük olduğu maddenin sıcaklığı ise daha düşük demektir.[/FONT]
[FONT="]Bir maddenin ortalama kinetik enerjisi ile orantılı olan büyüklüğe sıcaklık denir. Bir maddenin sıcaklığı değişiyorsa, çevresine ısı veriyor ya da çevresinden ısı alıyordur.[/FONT]
[h=1]Isı[/h][FONT="]Sıcaklıkları farklı olan maddeler bir araya konulduğunda aralarında enerji alış verişi olur. Alınan ya da verilen enerji ısı enerjisi denir.[/FONT]
[h=3]Isı ile Sıcaklığın Birbirinden Farkı[/h]
|
[FONT="]Termometrelerde 76 cm-Hg basıncında sabit iki sıcaklık değeri seçilir. Birisi suyun donma sıcaklığı diğeri ise suyun kaynama sıcaklığıdır.[/FONT]
[h=3]Sıcaklık Değerlerini Birbirine Dönüştürmek[/h][FONT="]Sıcaklık T ile sembolize edilir.[/FONT]
[FONT="]Celcius (Santigrad °C) termometrelerinde, suyun donma sıcaklığı 0 °C , kaynama sıcaklığı 100 °C alınarak, 100 eşit bölme yapılmıştır.[/FONT]
[FONT="]Kelvin suyun donma sıcaklığını 273 °K, kaynama sıcaklığını ise 373 °K alarak 100 eşit bölme yapmıştır.[/FONT]
[FONT="]Herhangi bir X termometresinde ise, suyun donma sıcaklığı – 10 °X, kaynama sıcaklığı ise 70 °X alınarak, 80 eşit bölme yapılmıştır.[/FONT]
[FONT="]

[FONT="]Termometrelerdeki sıcaklık değerlerini birbirine dönüştürmek için,[/FONT]
[FONT="]

[FONT="]eşitlikleri kullanılabilir.[/FONT]
[FONT="]Buradan çıkan sonuca göre, Celcius termometresindeki sıcaklık değeri 1 bölme yükselirse, Fahrenhait’te; 1,8 bölme, Kelvin’de 1 bölme; X termometresinde ise; 0,8 bölme yükselir.[/FONT]
[FONT="]Örneğin hava sıcaklığı 10 °C iken, Fahrenhait termometresi[/FONT]
[FONT="]F = 18 + 32 = 50 °F değerini gösterir.[/FONT]
[FONT="]Termometrenin Duyarlılığı[/FONT]
[FONT="]Küçük sıcaklık değişimlerinden etkilenen termometrelerin duyarlılığı daha fazladır. Bunun için termometrenin haznesinde daha fazla sıvı ve sıcaklıkla daha çok genleşen sıvı olmalıdır. Cıvanın tercih edilmesi bundan dolayıdır. Ayrıca kılcal boru dar olmalı ki genleşen sıvının hareketi rahat gözlenebilsin.[/FONT]
[FONT="]Yerçekim kuvvetinin sıfır olduğu bir yerde termometre çalışır. Çünkü genleşme yerçekimine bağlı değildir.[/FONT]
[FONT="]Isı Enerjisi[/FONT]
[FONT="]Maddenin sıcaklığını artırmak için verilmesi gereken enerji çeşidine ısı enerjisi denir. Q ile gösterilir. Isı bir enerji çeşidi olduğundan enerji birimleri ısı birimleri olarak alınabilir. Uluslararası birim (SI) sistemine göre enerji birimi Joule (Jul)dür.[/FONT]
[FONT="]1 cal = 4,18 Joule dür.[/FONT]
[h=3]Sıcaklık Değişimi[/h][FONT="]Elimizle bir maddeye dokunduğumuzda sıcaklık hissediyorsak madde elimize ısı veriyordur. Dokunduğumuzda soğukluk hissediyorsak elimiz maddeye ısı veriyordur.[/FONT]
[FONT="]Buna göre, sıcaklıkları farklı olan iki madde karıştırıldığında ya da birbirine değecek şekilde yan yana konulduğunda aralarında ısı alış verişi olur. Sıcak olan madde ısı verip sıcaklığı azalırken, sıcaklığı düşük olan madde ısı alarak sıcaklığı artar ve sonuçta ısıl denge sağlanır.[/FONT]
[FONT="][/FONT]
[FONT="]Isı akışı her zaman sıcak maddelerden soğuk maddelere doğru olur. Sıcaklıkları eşit olan maddelerde ısı alış verişi olmaz.[/FONT][h=3]Öz ısı[/h][FONT="]Herhangi bir maddenin 1 gr sıcaklığını 1°C artıran ısı miktardır. Her maddenin öz ısısı farklıdır.Dolayısıyla ayırt edeci bir özelliktir. Öz ısı “c” ile gösterilir. Ayırt edeci özellik madde miktarına bağlı değildir.[/FONT]
[FONT="]Bir cismin m gramının sıcaklığını DT kadar değiştirmek için verilmesi ya da alınması gereken ısı miktarı[/FONT]
[FONT="]Q=m.c.Dt[/FONT]
[FONT="]bağıntısı ile bulunur.[/FONT]
[FONT="]Bu bağıntıya göre, eşit kütleli maddelere eşit miktar ısı verildiğinde, öz ısısı küçük olan maddenin sıcaklık değişimi, öz ısısı büyük olanınkine göre daha fazla olur.[/FONT]
[h=3]Isı Sığası[/h][FONT="]M kütleli bir maddenin sıcaklığını 1°C artırmak iin gerekli olan ısı miktarıdır. Bir maddenin kütlesi ile öz ısısının çarpımına (m.c) ısı sığası denir. Isı sığası madde miktarına bağlıdır. Dolayısıyla ayırt edici bir özellik değildir.[/FONT]
[h=3]Isı Alış Verişi[/h][FONT="]Sıcakları farklı cisimler bir araya getirildiğinde sıcak cisim ısı vererek soğurken, soğuk cisim ısı alarak ısınır. Cisimler arasındaki ısı alışverişi iki isminde son sıcaklıkları eşitleninceye kadar devam eder. Isı akışı sıcak cisimden soğuk cisme doğru olur. Her zaman alınan ısı verilen ısıya eşittir.[/FONT]
[FONT="]Qalınan = Qverilen[/FONT]
[FONT="]m1 . c1 . DT1 = m2 . c2 . DT2[/FONT]
[FONT="]İki madde arasında hal değişimi yok ise, yukarıdaki eşitlik geçerlidir. Isıl denge sağlandığında iki maddenin son sıcaklığı kesinlikle eşit olur.[/FONT]
[FONT="]Sıcaklıkları T1 °C ve T2 °C olan aynı cins sıvıdan eşit kütleli karışım yapılırsa, karışımın son sıcaklığı[/FONT]
[FONT="]
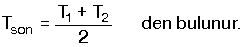
[FONT="]karışımın son sıcaklığı, karışan sıvıların sıcaklıkları arasında bir değerdir. T2 > T1 ise, T2 > Tson > T1 olur.[/FONT]
[h=3]ERİME ve DONMA[/h][FONT="]Maddelerin içinde bulunduğu sıcaklığa göre, katı, sıvı ve gaz halinde bulundukları biliniyor. Maddeler ısı alarak ya da ısı vererek bir halden diğer bir hale geçiş yapabilirler. Maddelerin bir halden başka bir hale geçmesine hal değiştirme denir.[/FONT]
[FONT="]Maddelerin katı halden sıvı hale geçmesine erime, sıvı halden katı hale geçmesine de donma denir.[/FONT]
[FONT="][/FONT]
[FONT="]Eğer bir maddeye ısı verildiği halde sıcaklığı değişmiyorsa madde hal değiştiriyor demektir. Madde hal değiştirirken sıcaklığı değişmez, verilen ısı enerjisi maddenin moleküller arasındaki bağları kopararak hal değiştirmesinde harcanır.[/FONT][FONT="]Hal değişim sırasında maddelerin hacminde de değişme olur.[/FONT]
[h=3]Erime Sıcaklığı[/h][FONT="]Sabit atmosfer basıncı altında bütün katı maddelerin katı halden sıvı hale geçtiği sabit bir sıcaklık değeri vardır. Bu sıcaklık değerine erime sıcaklığı ya da erime sıcaklık noktası denir.[/FONT]
[FONT="]Sabit atmosfer basıncı altında her maddenin erime sıcaklığı farklı olduğu için maddeler için ayırt edici bir özelliktir. Örneğin deniz düzeyinde buzun erime sıcaklığı 0 °C dir.[/FONT]
[h=3]Erime Isısı[/h][FONT="]Erime sıcaklığındaki bir katının 1 gramının yine aynı sıcaklıkta sıvı hale gelmesi için verilmesi gerekli ısıya erime ısısı denir. Erime ısısı da ayırt edici bir özelliktir. Kütlesi m olan, erime sıcaklığındaki bir katıyı eritmek için verilmesi gereken ısı miktarı,[/FONT]
| Q=m. Le |
[FONT="]Örneğin, buzun erime ısısı Le = 80 cal/g dır.[/FONT]
[FONT="]Sıvı bir maddenin ısı vererek katı haline geçmesine donma denir. Sabit atmosfer basıncı altında bütün sıvı maddelerin katı hale geçtiği sabit bir sıcaklık değeri vardır. Bu değere donma sıcaklığı ya da donma sıcaklık noktası denir.[/FONT]
[FONT="]Erime ile donma birbirinin tersidir. Bundan dolayı bir maddenin erime sıcaklığı, donma sıcaklığına eşittir. Erime ısısı da donma ısısına eşittir. Örneğin deniz düzeyinde 0 °C deki su donarken dışarı 80 cal/g lık ısı verir.[/FONT]
|
[h=5]1. Basıncın Erime ve Donmaya Etkisi[/h][FONT="]Basınç, birim yüzeye etkiyen dik kuvvet olduğundan, maddenin moleküllerini bir arada tutarak dağılmasını önleme yönünde etki eder.[/FONT]
[FONT="]Erirken hacmi artan maddeler için, basıncın artması erimeyi zorlaştırdığı için erime noktası yükselir. Basıncın azalması ise, erime noktasını düşürür.[/FONT]
[FONT="][/FONT]
[FONT="]Buz erirken hacmi küçülür. Dolayısıyla basıncın artması, hacmin küçülmesine yardımcı olduğu için erime sıcaklığı azalır. Buz için yani erirken hacmi küçülen maddeler için basıncın azalması erime sıcaklığını yükseltir.Deniz düzeyinde, normal basınçta 0 °C de eriyen buz, basınç artırılmasıyla sıfırın altındaki bir sıcaklıkta da eriyebilir.[/FONT]
[FONT="]Yüksek dağların zirvesindeki karların yaz mevsiminde de erimemesinin nedenlerinden birisi de açık hava basıncının yükseklere çıkıldıkça azalması ve karın erime noktasının yükselmesidir.[/FONT]
[h=5]2. Safsızlığın Erime ve Donmaya Etkisi[/h][FONT="]Saf bir maddenin içine başka bir madde karıştırılırsa, maddenin saflığı bozulur. Saf olmayan bu karışımın, saf maddeye göre erime ve donma sıcaklığı değişir.[/FONT]
[FONT="]Arabaların soğutucu suyunun içine antifriz denen maddenin karıştırılması suyun donma noktasını[/FONT]
[FONT="]– 20 °C, – 25 °C gibi sıcaklıklara indirmektedir.[/FONT]
[FONT="]Kışın hava sıcaklığının 0 °C nin altında olduğu durumlarda, yollardaki buzu eritmek için, tuz dökülür. Tuz, buzun erime noktasını düşürür ve (–) değerli sıcaklıklarda da buz eriyebilir.[/FONT]
[FONT="]KAYNAMA, BUHARLAŞMA ve SÜBLİMLEŞME[/FONT]
[h=3]Buharlaşma[/h][FONT="]Sıvı bir maddenin ısı olarak gaz haline geçmesi olayına buharlaşma denir. Buharlaşma olayı sıvı yüzeyinde olur. Isı alan sıvı moleküllerinden bazıları sıvı yüzeyinde,moleküller arası çekim kuvvetini ve sıvının yüzey gerilimini yenerek gaz fazına geçer.[/FONT]
[FONT="]Buharlaşmaya basınç ve diğer fiziksel şartların etkisi çoktur.[/FONT]
- · Buharlaşma her sıcaklıkta olabilir.
- · Maddeler dışarıdan ısı alarak buharlaşırlar. Dolayısıyla buharlaşmanın olduğu yerde serinleme olur.
- · Sıcaklığın artması buharlaşmayı hızlandırır.
- · Açık hava basıncının azalması buharlaşmayı artırır.
- · Sıvının açık yüzey alanı arttıkça buharlaşma daha fazla olur.
- · Rüzgarlı havada buharlaşma fazla olduğundan çamaşırlar daha çabuk kurur.
[h=3]Kaynama Sıcaklığı[/h][FONT="]Sabit atmosfer basıncı altında bütün sıvı maddelerin, sıvı halden gaz hale geçtiği sabit bir sıcaklık değeri vardır. Bu sıcaklık değerine kaynama noktası denir. Kaynama sıcaklığı maddeler için ayırt edici bir özelliktir.[/FONT]
[h=3]Buharlaşma Isısı[/h][FONT="]Kaynama noktasına gelmiş 1 gram sıvı maddenin tamamının aynı sıcaklıkta gaz haline gelmesi için verilmesi gereken ısıya buharlaşma ısısı denir. Buharlaşma ısısı Lb ile gösterilir. Kaynama sıcaklığındaki m gramlık maddeyi gaz haline getirmek için verilmesi gereken ısı miktarı[/FONT]
[FONT="]Q=m.Lb[/FONT]
[FONT="]bağıntısı ile bulunur. Suyun buharlaşma ısısı[/FONT]
[FONT="]Lb = 540 cal/g dır. Buharlaşma ısısı maddeler için ayırt edici bir özelliktir.[/FONT]
[FONT="]Gaz halindeki bir maddenin ısı vererek sıvı hale geçmesine yoğunlaşma denir. Erime ve donmada olduğu gibi, yoğunlaşma da, kaynamanın tersidir. Dolayısıyla bir maddenin kaynama sıcaklığı ile yoğunlaşma sıcaklığı eşittir. Buharlaşma ısısı ile yoğunlaşma ısısı da eşittir.[/FONT]
|
[FONT="]Kaynama ve Yoğunlaşmaya Etki Eden Faktörler[/FONT]
[FONT="]Yine erime ve donmada olduğu gibi, kaynama ve yoğunlaşmaya etki eden faktörler vardır. Basınç ve maddenin saflığının değiştirilmesi, kaynama sıcaklığını etkiler.[/FONT]
[FONT="]· Kaynama olayının gerçekleşmesi için, buhar basıncının atmosfer basıncına eşit olması gerekir. Atmosfer basıncı artarsa, ağzı açık kaptaki sıvının kaynaması zorlaşır. Atmosfer basıncının azalması ise kaynamayı kolaylaştırır. Dolayısıyla sıvı daha düşük sıcaklıkta kaynar.[/FONT]
[FONT="][/FONT]
[FONT="]Deniz düzeyinde 100 °C de kaynayan saf su, Ankara’da 96 °C de, Erzurum’da ise 94 °C de kaynar.[/FONT][FONT="]Düdüklü tencerede basıncın artmasıyla sıvının kaynama sıcaklığı artırılır, dolayısıyla yemekler daha çabuk pişer.[/FONT]
[FONT="]· Saf sıvı içine karıştırılan farklı maddeler sıvının saflığını bozar. Saflığı bozulan sıvının kaynama noktası değişir. Örneğin suyun içine tuz karıştırılırsa, kaynama noktası yükselir.[/FONT]
[h=3]Suyun Hal Değişim Grafiği[/h][FONT="]Bir parça buz ısıtıldığında önce sıcaklığı artar. Erime sıcaklığına geldiğinde hal değiştirmeye başlar ve buzun tamamı eriyinceye kadar sıcaklığı değişmez. Isı enerjisi verilmeye devam edildiğinde, suyun sıcaklığı artar ve 100 °C de kaynamaya başlar. Sıvının tamamı bitinceye kadar sıcaklık değişmez. Bu açıklamaya göre buzun sıcaklık-aldığı ısı enerjisi grafiği şekildeki gibi olur.[/FONT]
[FONT="]

[FONT="]Buzun erime ısısı Le = 80 cal/g, buharlaşma ısısı[/FONT]
[FONT="]Lb = 540 cal/g dır. Dolayısıyla 0 °C deki 1 gram buzu eritmek için 80 calorilik ısı gerekirken, 100 °C deki 1 gram suyu gaz haline geçirmek için 540 calori gerekir. Bundan dolayı DQ1 < DQ2 dir.[/FONT]
[FONT="]Madde ısı hızı sabit olan ocakla ısıtılıyorsa, ısı ekseni yerine zaman ekseni alınabilir.[/FONT]