[h=1]GAZLAR:[/h][FONT="]Maddeler tabiatta katı, sıvı ve gaz olmak üzere üç halde bulunurlar.[/FONT]
[FONT="]Tabiattaki gazlar gerçek gazlardır. Gerçek gazlar yüksek sıcaklık ve düşük basınçta ideale yaklaşırlar.[/FONT]
[FONT="]Farklı gazların ideal olmaları karşılaştırmasında ise;[/FONT]
[FONT="]Yoğunlaşma noktası düşük olan, molekül ağırlığı küçük olan gazlar diğerlerine göre daha idealdir, yorumu yapılabilir.[/FONT]
[h=3]GAZLARIN ÇÖZÜNÜRLÜÐÜ[/h][FONT="]Bir gazın herhangi bir sıvıdaki çözünürlüğü;[/FONT]
[h=3]GAZ BASINCININ ÖLÇÜLMESİ[/h][FONT="]Gaz basıncını ölçmeye yarayan aletlere manometre denir.[/FONT]
[FONT="]Toriçelli deniz seviyesinde civa kullanarak yapmış olduğu deney sonucu açık hava basıncını hesaplamıştır.[/FONT]
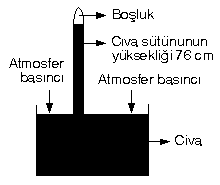
[FONT="]Sıvılar, basıncı her tarafa eşit olarak iletirler. Sıvı basıncı sıvının yüksekliğine ve yoğunluğuna bağlıdır. Cıvanın yoğunlugu 13,6 g/cm3, suyun yoğunluğu 1 g/cm3 tür.[/FONT]
[FONT="]Yukarıdaki deney civa yerine su kullanarak yapılsaydı,[/FONT]
[FONT="]Borudaki su yüksekliği: 76.13,6 = 1033,6 cm olurdu.[/FONT]
[FONT="] [/FONT]
[h=3]1. Kapalı Manometre[/h]

[FONT="] [/FONT]
[h=3]2. Açık Manometre[/h][FONT="]a.[/FONT]

[FONT="]Cıva seviyelerinin eşit olması X gazının basıncının açık hava basıncına eşit olduğunu ifade eder.[/FONT]
[FONT="]b.[/FONT]

[FONT="]X gazının basıncı açık hava basıncından h cm daha fazladır.[/FONT]
[FONT="]c.[/FONT]

[FONT="]X(g) nın basıncının açık hava basıncından daha küçük olduğu görülmektedir.[/FONT]
- Gaz hali genel olarak molekül ve atomların birbirinden uzak olduğu ve çok hızlı hareket ettiği bir haldir.
- Gaz molekülleri birbirine uzak olduğu için aralarında etkileşim yok denecek kadar azdır. Bu sebeple gaz molekülleri birbirinden bagımsız hareket ederler.
- Gazların hacim ve şekilleri işgal ettikleri kaba göre değişir. Bulundukları kabı doldururlar.
- Gazlar kolaylıkla sıkıştırılabilirler.
- Gazlar birbiriyle her oranda karışarak birinin yalnız başına işgal ettiği hacmi bu sefer beraberce doldururlar.
- Gazlar hızlı hareket ettiklerinden bulundukları kabın çeperine çarparlar ve bu çarpma neticesi kaba basınç uygularlar.
- Bulundukları kap içerisinde bütün yönlerde aynı basıncı uygularlar.
- Yoğunlukları katı ve sıvıya göre çok küçüktür.
- Isıtıldıklarında bütün gazlar sıcaklık değişimi karşısında aynı oranda genleşirler.
- Kolaylıkla bir ortamda yayılırlar.
- Gazların taneciklerinin oluşturduğu hacim, moleküller arasındaki boşluk yanında ihmal edilebilecek kadar küçüktür.
- Gaz molekülleri sabit bir hızla hareket ederken birbiriyle ya da bulundukları kabın duvarlarıyla çarpışırlar. Bu çarpışmalarda taneciklerin hızı ve doğrultusu değişebilir. Fakat çarpışmalar esnek olduğundan kinetik enerjide bir değişme olmaz.
- Gaz taneciklerinin sıcaklık değişimi ile hızları değişeceğinden ortalama kinetik enerjileri de değişir.
- Sıcaklıkları aynı olan bütün gazların ortalama kinetik enerjileri birbirine eşittir.
- Gaz molekülleri yüksek basınç düşük sıcaklıklarda sıvılaştırılabilirler.
[FONT="]Tabiattaki gazlar gerçek gazlardır. Gerçek gazlar yüksek sıcaklık ve düşük basınçta ideale yaklaşırlar.[/FONT]
[FONT="]Farklı gazların ideal olmaları karşılaştırmasında ise;[/FONT]
[FONT="]Yoğunlaşma noktası düşük olan, molekül ağırlığı küçük olan gazlar diğerlerine göre daha idealdir, yorumu yapılabilir.[/FONT]
[h=3]GAZLARIN ÇÖZÜNÜRLÜÐÜ[/h][FONT="]Bir gazın herhangi bir sıvıdaki çözünürlüğü;[/FONT]
- Gazın cinsine bağlıdır.
- Sıcaklık arttıkça azalır.
- Basınç arttıkça artar.
[h=3]GAZ BASINCININ ÖLÇÜLMESİ[/h][FONT="]Gaz basıncını ölçmeye yarayan aletlere manometre denir.[/FONT]
[FONT="]Toriçelli deniz seviyesinde civa kullanarak yapmış olduğu deney sonucu açık hava basıncını hesaplamıştır.[/FONT]

[FONT="]Yukarıdaki deney civa yerine su kullanarak yapılsaydı,[/FONT]
[FONT="]Borudaki su yüksekliği: 76.13,6 = 1033,6 cm olurdu.[/FONT]
| 76 cm Hg = 760 mm Hg = 1 atm |
[h=3]1. Kapalı Manometre[/h]

[h=3]2. Açık Manometre[/h][FONT="]a.[/FONT]

[FONT="]b.[/FONT]

[FONT="]c.[/FONT]
